
Privacy statement: Your privacy is very important to Us. Our company promises not to disclose your personal information to any external company with out your explicit permission.
Select Language
細胞培養プレートの選択と使用
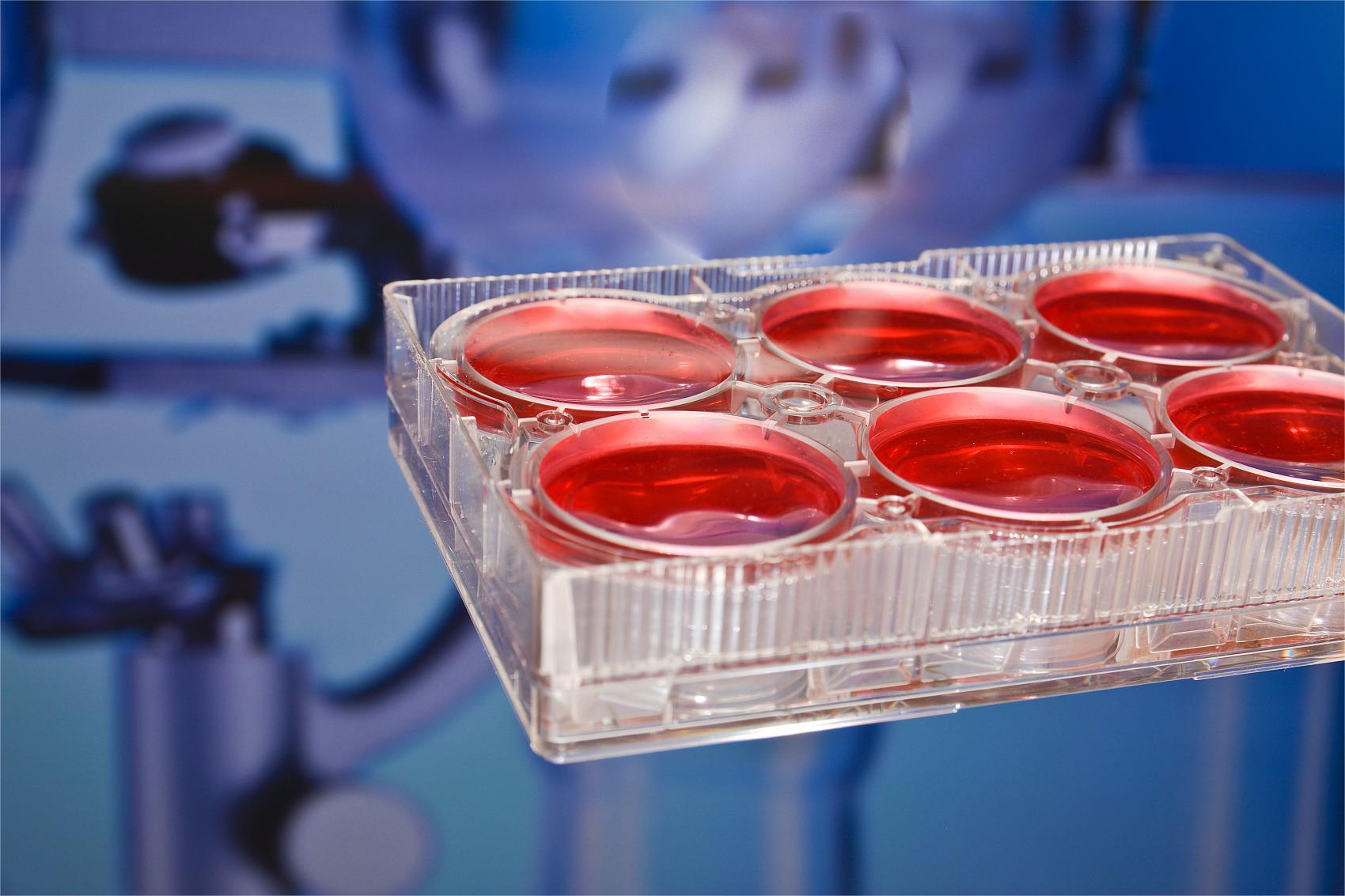
細胞操作を実行する際の厳格な不妊の原則は、細胞培養プレートにも適用されます。すべての操作は標準化された科学的でなければならず、細胞の成長に追加の影響はありません。最も一般的な問題の1つは、サンプルの添加後に細胞の均一性を確保し、細胞の成長状態に対する培地変化の影響を最小限に抑えることです。
聞く:
96ウェルの細胞培養プレートと24ウェルの細胞培養プレートまたはペトリ皿は非常にゆるいものであり、曝気に便利ですが、細菌、カビ、その他の汚染物質は滑り込みますか?答え:
蓋は非常にゆるく、半開き文化の一部です。これは曝気のためです(実際には、ペトリ皿の外側のCO2をペトリ皿と完全に交換して、培地のpHを維持できます)。
すべてには利点と欠点があり、もちろん汚染の可能性が高まります。さらに、これにより、ペトリ皿の液体が蒸発します。これは、薬物の正確な投与に顕著です。したがって、次の2つの測定値が必要です。インキュベーターの空気はきれいでなければなりません(通常のUV光、アルコールスクラブ、およびインキュベーターのオンとオフをできるだけ少ない)b。インキュベーターの湿度は常に100%に保持する必要があります(滅菌蒸留水を含む水タンクがインキュベーターに配置されます)。
ペトリ皿のように、それはまた、逆さまの蓋をした容器であり、汚染されません。主な理由は、カバーの「L」字型のエッジが負の空気圧を生成し、微生物がほこりに付着するようにし、気流によって運ばれる塵がカバーの端を通過することができないため、負の圧力を発生させることです。換気効果は、空気の拡散によるものであり、気流は生成されないため、菌は呼吸し、細菌を浸透させません。
聞く:
24ウェルプレートを使用して、いくつかの井戸では、操作があります(ベンチの内側)。私はこの方法で汚染が心配です、何に注意すべきかわからない。
答え:
ウルトラクリーンベンチでは、操作が標準化されている場合は、可能です。培養プレートのカバーを最大限に活用し、操作する穴だけを露出し、カバーで他の穴を覆うことができると思います。
使用する前に包括的に考え、すべての穴を最大限に活用してください。いくつかの穴だけを使用する必要がある場合は、片側のみを使用して、残りを蓋で覆うことができます。私は最初に右の穴を使用することに慣れています(右手はサンプルを追加するのに便利です)。
操作するときは、いくつかのガラススライドを使用してボードの片側を上げます。蓋を完全に開けないでください。一般的に問題ありません。
細胞と溶液の不均一な分布。
聞く:
細胞が培養板に播種されると、細胞は常に末梢部分に集まりますが、どうすればよいですか?
答え:
あなたの細胞はどのように混合されていますか?プレートをピペットしたり振ったりしていますか?それが後者であり、それが円で揺れている場合、遠心力のために細胞が周囲の部分に投げられ、中央の細胞が少なくなる可能性が非常に高いです!
ここに良い方法があります。種子板を培養する前に、培養プレートをインキュベーターに数時間飽和させてから取り出します。細胞を播種するとき、力は軽い必要があります。ゆっくりと追加して、細胞懸濁液がプレートのウェルに流れるようになり、培養細胞が大幅に均一に成長します。発振器を揺さぶることを忘れないでください。そうしないと、あなたの細胞はあなたが言ったように一緒に凝集します。
培養プレートの穴の直径が小さいほど、この現象はより明白です。液体の壁が穴の培地を液体レベルではなく培地にするため、24羽の壁と96ウェルプレートの現象は避けられませんが、介入の必要性のために凹面の鏡のように末梢は高くなっています。他の理由は、これらの2種類のウェルプレートを使用することで十分な培地を追加できないため、細胞は培地と一緒に「エッジ凝集」に見えるようにします。どのような指標を観察する必要があるかに応じて、MTTの場合、免疫組織化学は細胞層のために結果に影響します。
細胞を消化するときは、細胞の凝集を避けるためにピペッティングに均等に注意してください。井戸の培地の量は十分でなければなりません。一般に、接種中に十分な量の培地を追加する必要があり、介入が追加されたときに媒体を1回変更する必要があります。 、この場合、「エッジセット」の現象が改善されるため、試してみてください。
聞く:
私がしているのは、プラーク層実験です。細胞を均一な層に広げるのが最善ですが、ほとんどの穴はウイルスを接種するときは問題あり、一部は均一ではありません。細胞群には大きな違いがあります。セルを追加する際にどのような方法があるかを尋ねたいと思います。
答え:
細胞消化後、シングルセル懸濁液にピペットすることが重要です!各ウェルのセルの数が分割するときに同じであることを確認してください!
もちろん、処理因子のウェル間の並列性も非常に重要です。たとえば、薬を追加する場合、各井戸の濃度が一貫していることを確認するために、薬を希釈して混合する必要があります!
さらに、細胞と薬物を添加するとき、試験群と対照群を順番に追加する必要があります。
聞く:
吹くのはすでに均一ですが、厚板、6つの穴、24ホールは常に少し不均一であり、中央に少し集中しています。また、カウントが行われ、各穴の密度が1〜2日後に異なることは明らかであり、検出に影響します。良い戦略はありますか?
答え:
トランスファーピペットを使用する場合、ピペット内の細胞が自動的に沈むため、毎回あまり吸わないでください。最初のいくつかのウェルには多くの細胞があり、細胞懸濁液が均一でしばしば均一であり、液体が添加されます。 S字型に行く。ルート。
ピペットを使用する場合は、ヒントを処理する必要があり、各ピペットが1つのウェルに対応するように、セルの損傷を避けるためにヒントを削除する必要があります。先端で1対1の穴を追加する方が正確です。また、サスペンションの混合にも注意してください。平行グループを設定するには、nは十分に大きくする必要があります(計算できます)。めっき後に揺れないでください。揺れが細胞が中央に向かって凝集する可能性があるためです。一度にそれをすべて行うのが最善です。
LET'S GET IN TOUCH

Privacy statement: Your privacy is very important to Us. Our company promises not to disclose your personal information to any external company with out your explicit permission.

Fill in more information so that we can get in touch with you faster
Privacy statement: Your privacy is very important to Us. Our company promises not to disclose your personal information to any external company with out your explicit permission.